
Ikatan kimia Disodium Phosphate
Ikatan kimia Disodium Phosphate menjadi sorotan menarik karena menyajikan perpaduan struktur yang saling melengkapi antara elemen natrium, fosfor, hidrogen, dan oksigen. Senyawa ini membentuk hubungan yang kuat melalui kombinasi ikatan kovalen pada gugus fosfat dan interaksi ionik antara muatan positif serta negatif. Perpaduan ikatan tersebut menciptakan kestabilan alami yang mempertegas karakter uniknya sebagai senyawa yang memiliki keseimbangan struktur yang khas.
Struktur molekulnya terbangun dari gugus fosfat dengan geometri yang teratur, memungkinkan atom-atom penyusunnya berikatan secara harmonis. Ikatan antara fosfor dan oksigen memberikan kekokohan pada inti molekul, sementara atom natrium berperan penting dalam menjaga keseimbangan muatan. Susunan elektron yang stabil menjadikan ikatan kimianta tidak hanya kuat, tetapi juga memberikan ciri khas pada bentuk fisik maupun perilaku kimianya.
Keutuhan ikatan kimianya menunjukkan bagaimana interaksi antarunsur dapat menghasilkan struktur yang solid dan terorganisir. Gaya tarik elektrostatik, distribusi muatan, dan pola ikatan internalnya menciptakan keunikan tersendiri yang membedakannya dari banyak senyawa lainnya. Dengan memahami karakter ikatan ini, semakin mudah melihat bagaimana stabilitas dan ciri strukturalnya terbentuk secara alami melalui hubungan antaratom yang saling memperkuat.
Ikatan kimia Disodium Phosphate adalah satu topik memahami struktur, kestabilan, hingga perilaku senyawa tersebut dalam beragam kondisi.
Disodium Phosphate merupakan sebuah senyawa yang tersusun dari beberapa unsur utama, yakni natrium (Na), hidrogen (H), fosfor (P), dan oksigen (O). Keempat unsur tersebut membentuk rangkaian ikatan yang menghasilkan struktur stabil dengan karakteristik kimia yang mudah dikenali. Ikatan-ikatan di dalamnya berkembang secara teratur membentuk gugus fosfat yang berkorelasi erat dengan sifat senyawa secara keseluruhan.
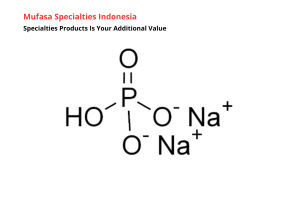
Senyawa ini memiliki kecenderungan untuk membentuk ikatan ionik dan kovalen secara bersamaan. Gugus fosfatnya terdominasi oleh ikatan kovalen antara fosfor dan oksigen, sedangkan keberadaan dua atom natrium memberi kontribusi ikatan ionik yang memperkuat struktur keseluruhan. Keanekaragaman ikatan tersebut membuat Disodium Phosphate menjadi contoh ideal untuk memahami bagaimana kombinasi ikatan kimia dapat memengaruhi perilaku sebuah molekul.
Selain itu, Disodium Phosphate dikenal memiliki tekstur kristalin dan stabil secara struktural. Stabilitas ini muncul karena keseimbangan antara ikatan elektrostatis serta konfigurasi elektron atom-atom penyusunnya. Dengan memahami ikatan kimia pada senyawa ini, kita dapat melihat bagaimana interaksi molekuler berperan dalam menentukan keunikannya.
Karakteristik Atom Penyusun
Sebelum membahas lebih jauh tentang jenis ikatan kimia yang terbentuk, penting untuk memahami sifat dasar atom penyusunnya:
1. Natrium (Na)
Natrium adalah unsur golongan alkali yang memiliki satu elektron valensi. Elektron tunggal ini sangat mudah terlepas, menjadikan natrium cenderung membentuk kation bermuatan positif. Hal inilah yang menjadi kunci terbentuknya ikatan ionik pada sodium hydrogen phosphate.
2. Fosfor (P)
Fosfor memiliki kecenderungan membentuk ikatan kovalen karena valensi elektronnya yang memungkinkan pembentukan berbagai struktur tetrahedral. Dalam sodium hydrogen phosphate, fosfor berada di pusat gugus fosfat dan berikatan dengan empat atom oksigen.
3. Oksigen (O)
Oksigen merupakan unsur dengan elektronegativitas tinggi. Sifat ini membuat oksigen cenderung menarik elektron kuat sehingga berperan besar dalam pembentukan ikatan kovalen polar. Dalam sodium hydrogen phosphate, oksigen membentuk beberapa jenis ikatan dengan fosfor, baik ikatan tunggal maupun ikatan rangkap.
4. Hidrogen (H)
Hidrogen berperan sebagai penyeimbang muatan pada gugus fosfat tertentu. Keberadaannya memungkinkan struktur senyawa mencapai kestabilan tertentu. Meskipun terlihat sederhana, peranan hidrogen tetap penting dalam menjaga keutuhan struktur Disodium Phosphate.
Keempat unsur ini membentuk tatanan atom yang tersusun rapi dan stabil, dengan interaksi yang berperan penting dalam keseluruhan karakteristik kimia senyawa.
Jenis-Jenis Ikatan Kimia
Salah satu keunikan Disodium Phosphate adalah keberadaan dua tipe ikatan kimia utama dalam struktur penyusunnya, yaitu:
1. Ikatan Kovalen
Ikatan kovalen mendominasi struktur gugus fosfat. Fosfor sebagai atom pusat membentuk empat ikatan kovalen dengan oksigen. Dua di antaranya berupa ikatan tunggal, sementara lainnya melibatkan ikatan rangkap. Pembagian elektron dalam ikatan ini merata, meskipun tetap ada polaritas tertentu karena perbedaan elektronegativitas antara fosfor dan oksigen.
2. Ikatan Ionik
Ikatan ionik hadir melalui interaksi antara atom natrium dan gugus fosfat bermuatan negatif. Natrium melepaskan elektron valensinya sehingga menjadi kation bermuatan positif, sementara gugus fosfat memanfaatkan muatan tersebut untuk mencapai stabilitas. Ikatan ionik ini menciptakan gaya tarik elektrostatik kuat yang menjaga Disodium Phosphate tetap kokoh dalam bentuk kristal.
Keberadaan dua jenis ikatan ini menghasilkan struktur hybrid yang memadukan kestabilan dari kovalen serta kekuatan gaya tarik dari ikatan ionik.
Struktur Molekul
Struktur Disodium Phosphate dapat dipahami sebagai kombinasi antara gugus fosfat sebagai inti molekul dengan dua ion natrium sebagai penyeimbang muatan. Gugus fosfat memiliki bentuk tetrahedral, dengan fosfor berada di pusat dan oksigen berada di titik-titik sudut. Susunan ini menciptakan stabilitas geometris yang khas dalam senyawa fosfat.
Atom natrium tidak berikatan secara langsung melalui ikatan kovalen, melainkan melalui interaksi ionik dengan oksigen bermuatan negatif pada gugus fosfat. Hal inilah yang menyebabkan natrium dapat bergerak lebih bebas daripada atom yang terikat kovalen secara langsung.
Struktur ini juga mendukung pembentukan kisi kristal yang kuat, dimana molekul-molekul saling tersusun secara teratur mengikuti pola elektrostatik yang stabil.
Peran Elektronegativitas
Elektronegativitas unsur-unsur penyusun Disodium Phosphate berperan besar dalam menentukan jenis dan polaritas ikatan yang terbentuk. Oksigen, sebagai unsur paling elektronegatif di dalam struktur ini, menarik elektron lebih kuat dari fosfor dan natrium.
Efek perbedaan daya tarik elektron ini menciptakan:
-
polaritas pada ikatan P–O,
-
pembentukan kation Na⁺,
-
kestabilan struktur ionik antara Na⁺ dan gugus fosfat.
Perbedaan elektronegativitas juga mendorong terbentuknya distribusi muatan yang spesifik, sehingga mempengaruhi kekuatan gaya tarik elektrostatik pada tingkat molekuler.
Pengaruh Ikatan Kimia terhadap Kestabilan
Kombinasi ikatan kovalen dan ionik membuatnya memiliki tingkat kestabilan yang cukup tinggi. Ikatan kovalen memastikan gugus fosfat memiliki struktur yang kuat dan tidak mudah berubah, sementara ikatan ionik memastikan susunan kristal tetap pada tempatnya.
Kestabilan ini pengaruhnya oleh beberapa faktor:
-
Susunan elektron pada atom fosfor dan oksigen
Ikatan kovalen rangkap memberikan kekuatan ekstra pada struktur gugus fosfat. -
Interaksi ionik antara natrium dan gugus fosfat
Menyediakan kekuatan tambahan secara elektrostatik, menjadikan molekul tetap kokoh dalam bentuk padat. -
Geometri tetrahedral
Meminimalkan tegangan ikatan sehingga meningkatkan kestabilan struktural.
Keunikan Ikatan Phosphate pada DSP
Gugus fosfat adalah inti dari semua sifat struktural DSP. Keunikan utama gugus ini meliputi:
-
struktur tetrahedral yang sangat stabil,
-
kombinasi ikatan tunggal dan rangkap,
-
distribusi muatan yang terlokalisasi,
-
kemampuan berinteraksi dengan ion positif seperti natrium.
Keunikan interaksi ini membuat ikatan fosfat tidak hanya kuat, tetapi juga serbaguna dalam berbagai kondisi. Ikatan rangkap P=O, khususnya, memiliki peran penting dalam menjaga kestabilan molekul terhadap tekanan lingkungan.
Interaksi Antar Molekul
Selain ikatan internal, interaksi antar molekul juga memengaruhi sifat keseluruhan senyawa. Gaya tarik antar molekul terutama dominasinya adalah oleh gaya elektrostatik dari muatan positif dan negatif. Pola interaksi ini menyebabkan molekul-molekul Disodium Phosphate dapat tersusun rapi dalam bentuk kisi kristal yang teratur. Interaksi ini pula yang mendukung ketahanan struktural senyawa ketika berada dalam perubahan kondisi tertentu.
Ikatan kimia Disodium Phosphate adalah gabungan ideal antara ikatan kovalen dan ionik yang bekerja bersama-sama menciptakan struktur stabil dan teratur. Memahami ikatan kimia pada senyawa ini memberikan gambaran jelas mengenai bagaimana susunan atom bekerja dalam menghasilkan struktur molekul yang kokoh dan harmonis.






